
1.下列关于物质性质和用途的说法不正确的是( )。(B)
A. 干冰升华时吸收大量的热,干冰可用作制冷剂
B. 铝不与空气反应,铝制品可不用涂保护层来防腐
C. 小苏打能与酸反应生成气体,小苏打可制作发酵粉
D. 稀有气体在通电时能发出不同颜色的光,稀有气体可制作霓虹灯
答案解析:铝与空气中的氧气反应,生成一层致密的氧化物保护膜,因此,铝制品可不用涂保护层来防腐。
2.下列物质在水溶液中能大量共存的是( )。(D)
A. NH4Cl、K2CO3、NaOH
B. HCl、Na2SO4、KOH
C. BaCl2、KCl、CuSO4
D. K2SO4、NH4HCO3、NaCl
答案解析:NH4Cl、NaOH溶液中能相互反应生成氯化钠、氨气和水,不能大量共存;HCl、KOH在溶液中能发生反应生成氯化钾和水,不能大量共存;CuSO4、BaCl2在溶液中能相互反应生成硫酸钡沉淀和氯化铜,不能大量共存;K2SO4、NH4HCO3、NaCl三种物质在溶液中不发生反应,能大量共存。
3.NA为阿伏加德罗常数的值。下列说法正确的是( )。(D)
A. 标准状况下,2.24L四氯化碳含有的分子数为0.1NA
B. 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 在常温常压下,2.24LSO2与O2混合气体中含有氧原子数为0.2NA
D. 若由CH4与C2H4组成的混合物中共有NA个分子,其中氢原子数为4NA
答案解析:标准状况下,四氯化碳是液体,所以2.24L四氯化碳含有的分子数不是0.1NA;25℃时,pH=13的NaOH溶液体积未知,所以其含有OH-的数目无法确定;在常温常压下,2.24LSO2与O2混合气体的物质的量不是0.1mol,所以,在常温常压下,2.24L SO2与O2混合气体中含有氧原子数不是0.2NA。
4.铋(Bi)在医药方面有重要应用,下列关于83209Bi和83210Bi的说法正确的是( )。(B)
A. 83209Bi和83210Bi都含有83个中子
B. 83209Bi和83210Bi互为同位素
C. 83209Bi和83210Bi的核外电子数不同
D. 83209Bi和83210Bi分别含有126和127个质子
答案解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。质子数和中子数之和等于质量数,所以83209Bi含有的质子数为83、中子数为126,83210Bi含有的质子数为83、中子数为127,A、D两项错误。二者的质子数相同,但中子数不同,二者互为同位素,B项正确。质子数=核外电子数,所以二者的核外电子数也是相同的,C项错误。
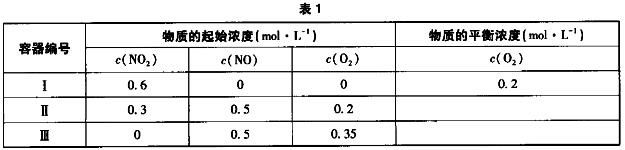
5.温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO7(g) 2NO(g)+O2(g)(正反应吸热),实验数据如表1。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )。
2NO(g)+O2(g)(正反应吸热),实验数据如表1。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )。
 (D)
(D)A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4:5
B. 达平衡时,容器Ⅱ中c(O2)/c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数大于50%
D. 当温度改变为T2时,若k正=k逆,则T2>T1
答案解析:根据反应方程式和容器I中O2的平衡浓度可知,平衡时,c(O2)=0.2mol·L-1,列三段式计算,可求得平衡时c(NO)=0.4mol·L-1、c(NO2)=0.2mol·L-1,则T1温度下,该反应的平衡常数K=[c2(NO)·c(O2)]/c2(NO2)=(0.42×0.2)/0.22=0.8。平衡时,容器Ⅰ中气体总物质的量为0.8mol,容器Ⅱ中,气体起始总物质的量为1mol,此时[c2(NO)·c(O2)]/c2(NO2)=5/9<K,反应正向进行,气体物质的量增大,气体起始总物质的量大于1mol,则达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于4:5,A项错误。根据分析可知,平衡时,容器Ⅰ中c(O2)/c(NO2)=1。当容器Ⅱ中c(O2)/c(NO2)=1时,c(NO)=(0.5+0.2/3)mol·L-1,c(NO2)=(0.2+0.1/3)mol·L-1,c(O2)=[0.2+(0.1/3)]mol·L-1,此时[c2(NO)·c(O2)]/c2(NO2)≈1.38>K,反应逆向进行,则c(O2)/c(NO2)<1,即达到平衡时,容器Ⅱ中c(O2)/c(NO2)比容器Ⅰ中的小,B项错误。设容器Ⅲ中NO的体积分数为50%,则c(NO)=0.4mol·L-1,c(NO2)=0.1lmol·L-1,c(O2)=0.3mol·L-1,此时[c2(NO)·c(O2)]/c2(NO2)=4.8>K,反应逆向进行,则NO的体积分数减小,因此平衡时,NO的体积分数小于50%,C项错误。平衡时,正、逆反应速率相等,则有k正c2(NO2)=k逆c2(NO)·c(O2),若k正=k逆,则[c2[***还有12037个字符未阅读,点击下载文档阅读全文***]





