
1.在3支大小相同的试管中各加入2mL5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末,2滴1mol/L FeCl3溶液,对比观察现象,该实验的目的是( )。(D)
A. 探究浓度对反应速率的影响
B. 探究温度对反应速率的影响
C. 探究固体表面积对反应速率的影响
D. 探究催化剂对反应速率的影响
答案解析:在3支大小相同的试管中各加入2mL5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末、2滴1mol/L FeCl3溶液,二氧化锰和铁离子对双氧水的分解起到催化剂的作用,没加入催化剂的试管中无气泡产生,加入催化剂的试管中气泡快速产生,即该实验的目的是探究催化剂对反应速率的影响。故本题选D。
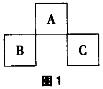
2.A、B、C均为周期表中的短周期元素,它们在周期表的位置如图1所示。已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A元素的原子序数的4倍,则A、B、C是( )。
 (C)
(C)A. Be、Na、Al
B. B、Mg、S
C. O、P、Cl
D. C、Al、P
答案解析:A、B、C均为短周期元素,B、C两元素的原子序数之和是A元素的原子序数的4倍,设A元素原子序数为x,B元素原子序数为x+7,C元素原子序数为x+9,则4x=x+7+x+9,解得x=8,则A为O元素、B为P元素、C为Cl元素。故本题选C。
3.2018年,一档《辉煌中国》电视纪录片,让“厉害了,我的国”成了不少人的口头禅。我国科技创新成果卓越,下列成果中获得诺贝尔奖的是( )。(B)
A. 侯德榜发明联合制碱法
B. 屠呦呦发现抗疟疾青蒿素
C. 闵恩泽研发石油炼制催化剂
D. 张青莲主持测定了几种元素相对原子质量的新值
答案解析:候德榜发明联合制碱法,没有获得诺贝尔奖,故不选A项;屠呦呦发现抗疟疾新药青蒿素,获得了2015年度诺贝尔生理学或医学奖,故选B项;闵恩泽研发石油炼制催化剂,没有获得诺贝尔奖,故不选C项;张青莲主持测定了几种元素相对原子质量的新值,没有获得诺贝尔奖,故不选D项。故本题选B。
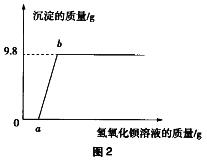
4.某溶液中可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图2所示。下列有关说法正确的是( )。
 (B)
(B)A. 加入氢氧化钡溶液至过量,共发生了三个化学反应
B. 该溶液中一定含有盐酸、氯化铜,可能含有硝酸钠
C. 反应过程中生成的沉淀一定有氢氧化铜,可能有硫酸钡
D. 到达6点时所消耗氢氧化钡溶液中溶质的质量是17.1g
答案解析:由图像可以看出,加入氢氧化钡溶液经过一段时间才出现沉淀,因此溶溶液中不含有硫酸,产生的沉淀是氢氧化铜沉淀。在向一定质量的该溶液中逐滴加入氢氧化钡溶液的过程中发生两个反应,先是酸碱中和反应:2HCl+Ba(OH)2=BaCl2+2H2O,待稀盐酸全部反应完后,接着发生氯化铜和氢氧化钡的反应:CuCl2+Ba(OH)2=Cu(OH)2↓+BaCl2。因此,可以判断出,该溶液中一定含有盐酸、氯化铜,可能含有硝酸钠,一定不含有硫酸。由上述推断可知,加入氢氧化钡溶液至过量,共发生了两个化学反应,A项错误;该溶液一定含有盐酸、氯化铜,可能含有硝酸钠,B项正确;反应过程生成的沉淀一定是氧氧化铜,一定没有硫酸钡,C项错误;由方程式可知,生成9.8g氢氧化铜沉淀需要17.1g氢氧化钡,因此到达6点时,所消耗氢氧化钡溶液中溶质的质量大于17.1g,因为与盐酸反应也需要消耗氢氧化钡,D项错误。故本题选B。
5.温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) 2HI(g)AH<0。实验数据如表1。实验测得:v正=v(H2)消耗=v(I2)消耗=K正c(H2)·c(I2),v逆=v(HI)消耗=K逆c2(HI),K正、K逆为速率常数,受温度影响,下列说法正确的是( )。
2HI(g)AH<0。实验数据如表1。实验测得:v正=v(H2)消耗=v(I2)消耗=K正c(H2)·c(I2),v逆=v(HI)消耗=K逆c2(HI),K正、K逆为速率常数,受温度影响,下列说法正确的是( )。
 (C)
(C)A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比小于1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=K正/K逆成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1mol12和0.1molHI,则此时v正>v逆
答案解析:假设能按照比例完全转化为HI,反应过程中,容器Ⅰ与容器Ⅱ中气体物质的量之比等于气体的总压强的比即1:3,A项错误;两容器达平衡时:c(HI,容器Ⅱ)=3c(HI,容器I),B项错误;温度一定,容器Ⅱ中反应达到平衡状态,v正=v逆,v正=v(H2)消耗=v(I2)消耗=K正c(H2)·c(I2),v逆=v(HI)消耗=K逆c2(HI),K正、K逆为速率常数,c2(HI)=v逆/K逆,据此计算平衡常数K=c2(HI)/[c(H2)c(I2)]=K正/K逆,C项正确;列方程式计算,可求出容器I达到平衡时H2、I2、HI的浓度为0.07mol·L,0.07mol·L-1,0.06mol·L-1,则K=0.062/(0.07×0.07)=0.73,达到平衡时,向容器I中同时通入0.1mol I2和0.1mol HI,则Qc=0.162/(0.17×0.07)=2.15>K,所以v正<v逆,D项错误。故本题选C。
6.H2S为二元弱酸,20℃时,向0.100mo[***还有13469个字符未阅读,点击下载文档阅读全文***]





